DR. JOSEPH MONSONEGO
– ředitel Institutu du Col, Paříž,
– prezident organizace EUROGIN (European Research Organization on Genital Infection and Neoplasia)
– prezident mezinárodní nadace WACC (Women Against Cervical Cancer)
Existují silné důkazy o tom, že HPV infekce je sice nezbytným, nikoliv však jediným faktorem nutným pro vývoj prekancerózních a kancerózních lézí děložního čípku. V současnosti je znám velký počet typů HPV, ale pouze u zlomku z tohoto počtu byl opravdu potvrzen onkogenní potenciál. Patnáct z nich je pak pokládáno za vysoce rizikové z hlediska vzniku karcinomu děložního hrdla, s mírou nejvyššího rizika je přímo spojeno pět typů (16, 18, 31, 33 a 45), v případě typů 16 a 18 je to až 60 % CIN3 a 70 % karcinomu (pozn. překl.: CIN3 je léze závažného stupně, odpovídá těžké dysplazii). Tradiční pohled na onemocnění je nutno v plném rozsahu přehodnotit se zřetelem na vysoce rizikovou expozici nejaktivnějším typům HPV.
Přenos infekce se děje všemi způsoby sexuálního styku, nejcitlivější a nejzranitelnější oblastí je přitom hrdlo děložní a to patrně díku tomu, že jeho transformační zóna je snadno přístupna kontaktu s vlastním virem (pozn. překl.: transformační zóna je pásmo epiteliální přeměny; probíhá zde metaplastický proces přeměny cylindrického v dlaždicový epitel a je obecně náchylnější k onkogenním změnám). V průběhu života riziko přímého kontaktu s HPV dosahuje u žen až 70% hranice a celoživotní riziko vzniku cervikálního karcinomu se odhaduje mezi 0,6 – 3 %.
Nejvyšší prevalence HPV infekce je mezi 20 – 25 rokem, kdy dosahuje úrovně 30 %, se stoupajícím věkem pak postupně klesá až na rozmezí 10 – 12 %. Mladé ženy představují skupinu s nejvyšší mírou rizika. Svou roli zde může hrát vyšší expozice viru díky častějšímu střídání sexuálních partnerů, nezralost metaplastického epitelu transformační zóny i určitá nedostatečnost imunitních obranných mechanismů. Přesto může být v řadě případů vlastní infekce přechodná a spontánně odeznít v rozmezí 18 – 36 měsíců zejména, když je způsobena méně aktivními typy virů.
Vymizení viru lze připsat na vrub činnosti přirozené imunity, ale i dalším – dosud ne zcela jasným – mechanismům. Nicméně přirozená imunita sama o sobě nezajišťuje celoživotní ochranu a opětovná nákaza dokonce stejným typem viru je snadná. HPV infekce tedy sama o sobě neimunizuje organismus, nutná je vakcinace (pozn. překl.: očkování je účinné pouze na určité typy virů a i tak se může reinfekce objevit).
Nejvýznamnějším indikátorem lézí je perzistence viru. Kumulativní riziko CIN3 u perzistentní infekce HPV typem 16 v délce převyšující 10 let je 50 %. Mezi markery perzistence je uváděna řada faktorů včetně věku, kouření, přítomnosti chlamydiové infekce, perorální kontracepce i imunosuprese (pozn. překl.: imunosupresi mohou navodit některá léčiva). Tytéž faktory pak představují riziko vzniku cervikálního karcinomu. Např. v membránách buněk epitelu děložního hrdla byl zjištěn nikotin s jeho metabolity, samotné kouření má negativní vliv na lokální imunitní mechanismy. Ženské pohlavní hormony svým efektem na buněčnou proliferaci mohou indukovat citlivost k poškození DNA cílových buněk.
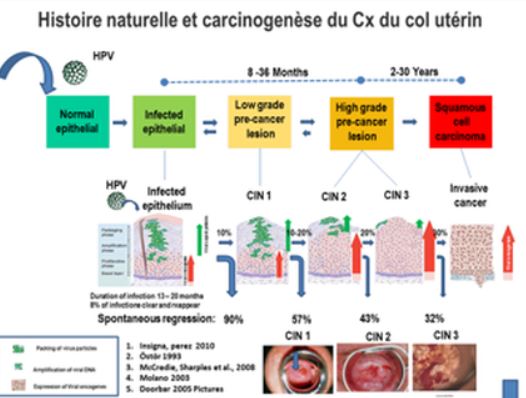
Výsledkem dlouhodobé expozice HPV, zejména pak výše zmiňovaným nejaktivnějším typům, je vývoj karcinomu v oblasti děložního hrdla. Morfologickým podkladem infekce mohou být nízce stupňové (LSIL) léze, které ještě mohou projít regresí a spontánně vymizet díky postupně se rozvíjející obranné reakci imunitního systému. Vysoce stupňové léze (HSIL) jsou všeobecně považovány za změnu s vysokou mírou rizika postupné progrese v karcinom. Observační studie ukazují, že doba potřebná k tomu, aby perzistující HPV infekce prošla přes počáteční změny transformační zóny až po samotný karcinom dosahuje 15 – 20 let, jsou však známy i kratší intervaly této progrese. Specifické mechanismy tohoto přechodu jsou s nejvyšší pravděpodobností výsledkem interakce virového agens s přirozenou imunitou hostitele, jejíž jednotlivé složky nejsou zcela známy. Počáteční imunitní reakce je pravděpodobně zprostředkována lokálními ději vrozené imunity s účastí přirozených zabíječů (natural killer cells, NK-buňky) a aktivací receptorů podobných toll (pozn. překl.: toll-like receptory byly nejprve objevené u larev mušky octomilky, kde se mohou podílet na poruchách larválního vývoje – odtud „toll“ ve smyslu zmatený). Pokračující přítomnost viru pravděpodobně vede k adaptivní imunitní reakci založené na aktivitě antigen-prezentujících buněk s účastí jak přirozené (vrozené), tak získané (adaptivní) složky imunity. Po penetraci viru dochází k jeho kontaktu s bazálními buňkami, jedná se o omnipotentní buňky, které jsou citlivé na virion v oblasti skvamocelulární junkce (poz. překl.: jedná se o hranice mezi dlaždicovým epitelem děložního hrdla a žlazovým endocervikálním epitelem). Zde dochází k expresi a maturaci genů proteinů L1 a L2 (pozn. překl.: L1 je hlavní strukturální protein virového „obalu“ – kapsidy; L2 je protein kompletující samotný virion inkorporací virového genetického materiálu do DNA hostitelské buňky).
Působením virových onkoproteinů E6 a E7 se původně diferencovaný epitel LSIL léze postupně transformuje na stále méně a méně diferencovaný epitel HSIL (pozn. překl.: protein E6 inaktivuje mechanismy zajišťující integritu hostitelské buňky; E7 inaktivuje buněčný protein pRb, jehož fyziologickou funkcí je tlumit nekontrovatelné buněčné dělení). Onkoproteiny E6 a E7 zasahují do cyklu buněčného dělení narušením funkce regulačních proteinů p53 a pRb (pozn. překl.: protein p53 má řadu funkcí, mimo jiné i stimuluje proces diferenciace buněk a zahájení apoptózy). Buňka se důsledku toho stává nestabilní a virus tak dosahuje v LSIL lézi schopnosti dalšího šíření, v HSIL lézi je – pokud známo – v epizomálním stavu (pozn. překl.: epizomální – mimo buněčné chromozómy; epizomální stadium je typické pro latentní průběh infekce a proto nedochází k jejím klinickým projevům). V LSIL lézi dochází k dokončení replikace viru, z epizomálního stadia v HSIL lézi může být inkorporován do genomu hostitelské buňky a dochází ke vzniku nádorové buňky.
Mikrobiota a HPV
Mikrobiota obecně hraje důležitou úlohu v lidském zdraví. Je známo, že dysbalance v rámci mikrobioty se může podílet na vzniku karcinomu tlustého střeva či atopické dermatitidy. Hlavní složkou mikrobioty vaginy je početná skupina bakterií Lactobacillus acidophillus, jejíž složení a vzájemný poměr mohou ovlivňovat stav lokální imunity.
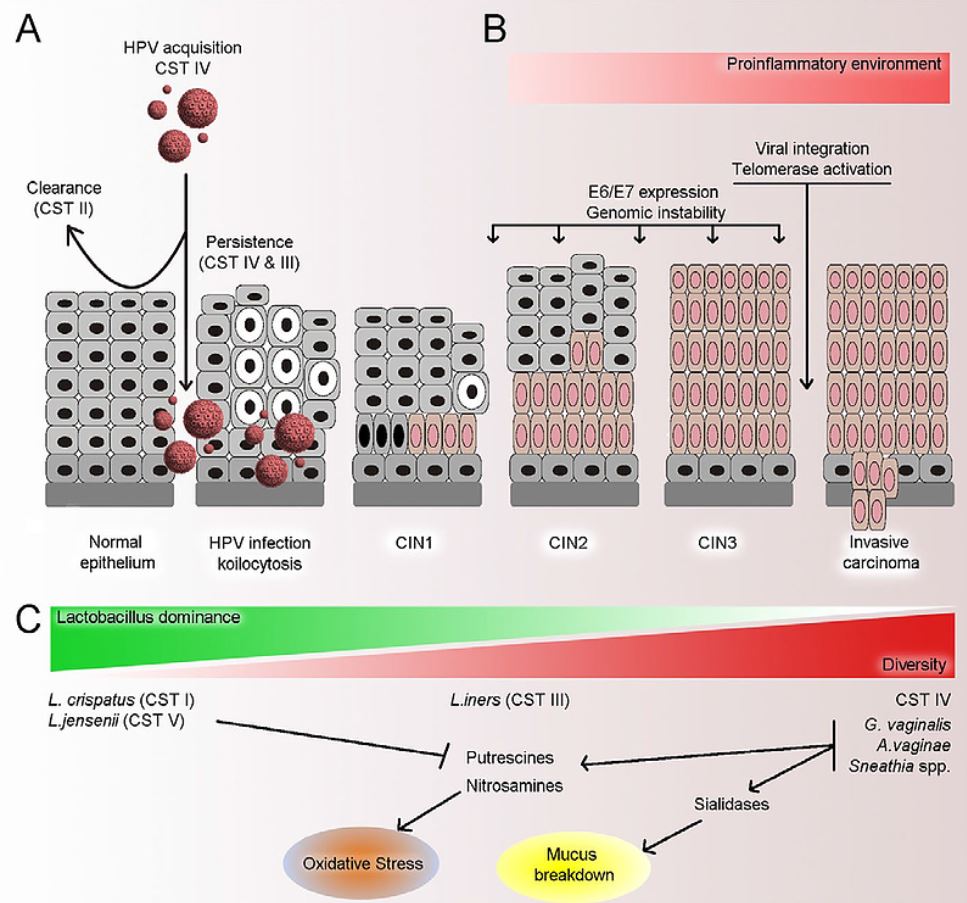
Metodami in vitro bylo zjištěno, že některé laktobacily (Lactobacillus spp.) mají cytotoxický efekt na nádorové buňky karcinomu čípku. Ukazuje se tedy, že mezi mikrobiotou , látkami jí produkovanými a buňkami děložního hrdla existuje vzájemná interakce. Existují i důkazy o možnosti ovlivnění HPV infekce aktuálním stavem poševní mikroflóry. Metaanalýzou celkem 12 klinických studií byla potvrzena pozitivní korelace mezi HPV infekcí a současnou přítomností bakteriální vaginózy. Deplece bacilů podporuje perzistenci HPV infekce, zjistilo se, že ženy s perzistující HPV infekcí měly i 11% prevalenci vaginózy ve srovnání s 5% prevalencí u žen bez HPV. U žen s vaginózou došlo také k prodloužení doby nutné k spontánnímu vymizení HPV (poměr rizik – hazard ratio HR = 0,84; 95% Cl 0,72 – 0,97). Jedna z prvních studií vyšetřující vztah poševní mikrobioty a HPV byla provedena v Koreji. Bylo analyzováno 68 pacientek, z nichž 23 vykazovalo HPV pozitivitu a 45 bylo HPV negativních. HPV-pozitivní ženy měly vyšší diverzitu mikrobioty s nižším podílem Lactobacillus spp. ve srovnání s HPV-negativními. Analýza také ukázala, že určité bakterie (fusobakterie, zejména Prevotella) lze využít jako mikrobiologický marker HPV infekce.
Ačkoliv výše uvedená fakta ukazují na důležitost mikrobioty při modulaci imunitní reaktivity ženských pohlavních cest, řada otázek stále čeká na odpověď:
– může složení mikrobioty vyskytující se současně s nediferencovanou skvamozní metaplazií u mladých žen vysvětlit vyšší výskyt HPV infekce v tomto věku?
– mají rizikové faktory, jako kouření, imunosuprese, perorální kontracepce, negativní vliv na takové změny mikrobioty, které by podporovaly proces kancerogeneze ?
– jsou věkově závislé rozdíly v prevalenci HPV, HSIL a cervikálního karcinomu výsledkem změn složení mikrobioty?
– mohou naopak HPV infekcí indukované změny ve složení mikrobioty spustit onkogenní faktory vedoucí ke kancerogenezi?
– Závěr –
Závěrem lze říci, že poševní mikrobiota má zřejmě význam při nákaze a perzistenci HPV infekce, včetně její progrese do vyšších stádií CIN. Pro potvrzení tohoto předpokladu však budou nutné další studie zaměřené na zkoumání souvislosti složení a diverzity mikrobioty s klinickými projevy.
Získané poznatky tak mohou poskytnout příležitost k vývoji nových léčiv cílených na zachování a obnovení poševní mikrobioty, mohlo by se např. jednat o specifická probiotika, bioselektivní substráty podporující růst laktobacilů zabraňujících vzniku a vývoji prekancerogenních lézí.
Dr. Javier Cortés Bordoy
– starší konzultant oboru ženské onkologie,
– soukromý lékař,
– bývalý prezident Španělské asociace cervikální patologie a kolposkopie
– prezident EUROGIN 2015
Cílem této zprávy je posouzení prospěšnosti přípravku Papilocare® se zvlhčujícími a regeneračními účinky na vaginální sliznici ve vztahu k re-epitelizační funkci v případech, kdy dochází k mikrotraumatům sliznice. Tímto způsobem přípravek zabraňuje integraci viru do buněk a předchází tak HPV infekci.
Studie Cleopatra l zjistila průměrnou četnost HPV infekce u celého souboru žen ve věku mezi 18 – 68 lety vy výši 14 %, přitom ve skupině s věkovým rozmezím 18 – 30 let se četnost pohybovala na stabilní úrovni 30 %, ve věku 30 – 35 let pak došlo k poklesu na úroveň pohybující se kolem 10 %. Na základě těchto výsledků lze říci, že ve Španělsku je v průběhu první třetiny života přítomnost HPV v poševní sliznici běžná. Z důvodu stále většího počtu známých příčin ( mimo jiné typ viru, aktuální stav obranyschopnosti organismu hostitele) existuje možnost spontánního vymizení infekce s výjimkou určité skupiny žen, kdy k tomu nedochází. Tuto skupinu lze charakterizovat jako chronické přenašečky HPV. Právě u těchto žen jsme nuceni předpokládat existenci vysokého rizika počátečního vývoje prekancerózních lézí v oblasti čípku, které mohou ve vysokém procentu vést k vývoji invazivního karcinomu této oblasti. Vysoké riziko ovšem ještě neznamená naprostou jistotu. Na základě zdokumentovaných invazivních karcinomů se ukázalo, že pouze u omezeného počtu žen došlo k vývoji CIN3. Proč tomu tak je?
– Patogeneze HPV infekce –
Výše uvedené úvahy týkající se procesu infekce jsme v nedávné době doplnili o vlastní poznatky. I když je to velmi jednoduché, nutno mít na paměti, že pouhá přítomnost HPV v cervikální či anální mukoidní tekutině nemusí ještě znamenat vlastní HPV infekci. Být opravdu nakažen představuje další krok, který znamená, že došlo k integraci samotného viru, tzn. k jeho přesunu z tekutiny do vlastního epitelu děložního hrdla a postupnému ovládnutí cílových buněk. Existuje proto stále více důkazů o prospěšnosti technik průkazu virové mRNA a exprese onkogenů E6 a E7, které jsou zároveň markery integrace viru do genomu napadené buňky a tudíž i samotného zahájení onkogenního procesu. Děložní hrdlo samo o sobě představuje nestabilní histologickou strukturu, kde se neustále střetává rozhraní dvou epitelií a to vrstevnatého dlaždicovitého epitelu části čípku vyklenující se do pochvy (pozn.: ektocervix) a jednovrstevného cylindrického žlázového epitelu děložního kanálu (pozn.: endocervix). Pod cylindrickým epitelem se nachází linie rezervních buněk, které si zachovávají schopnost růstu a následné diferenciace a to nejčastěji do zralých forem buď skvamozních nebo žlázových epitelií.
Při dělení rezervních buněk dochází v průběhu pohlavního vývoje ženy k jejich proliferaci a vyhřeznutí endocervikálního epitelu směrem navenek (tj do ektocervixu). Žlazový epitel se vlivem odlišného prostředí vaginy mění na epitel dlaždicový. Ve své podstatě se jedná o normální proces, který probíhá u každé sexuálně aktivní ženy a je stimulován i užíváním perorální kontracepce., zavedením nitroděložního tělíska či prostým těhotenstvím. HPV potřebuje ke své integraci mitotickou aktivitu buněk. Tuto podmínku splňují právě rezervní buňky ve stadiu metaplastické re-epitelizace a představují tak ideální cíl pro ukotvení viru. Z toho plyne, že na druhé straně dobře epitelizovaný cervix se skvamozním (= spinocelulárním) epitelem a omezeným prolapsem transformační linie či její nepřítomností je méně vhodným prostředím pro kolonizaci viry i onkogenní potenciál HPV infekce.
Papilocare® – možnost preventivní strategie
Máme důkazy potvrzující, že vaginální gel Papilocare® podporuje re-epitelizaci cervixu; Předpokládáme proto, že jeho prostřednictvím je možné omezit integraci viru zmenšením citlivé oblasti epitelu s intenzivní mitotickou aktivitou, která jinak představuje dokonalé místo integrace HPV. V tomto prostředí se tak možnost ukotvení HPV s onkogenním potenciálem významně snižuje.
– Závěr –
S ohledem na výše uvedená fakta a na podkladě vlastních výsledků souhlasím s tím, že „bariérový efekt“ vyvolaný Papilocare® opravňuje uvažovat o možnostech jeho použití u pacientek s narušenou cervikální epitelizací, což brání integraci viru a rozvoji HPV infekce.

